核酸適配體(aptamer)由諾獎(jiǎng)獲得者Jack Szostak命名,是一類短的���、單鏈DNA(ssDNA)或RNA寡核苷酸��,通過(guò)形成三維空間結(jié)構(gòu)����,結(jié)合特定蛋白或者細(xì)胞發(fā)揮作用���?����;谄洫?dú)特的生物學(xué)和化學(xué)特性�,核酸適配體正在用于診斷試劑和治療藥物的開發(fā)。指數(shù)富集的配體系統(tǒng)進(jìn)化技術(shù)(SELEX)是核酸適配體篩選的金標(biāo)準(zhǔn)方法�,主要基于核酸文庫(kù)與目標(biāo)蛋白或細(xì)胞在溶液中或者在細(xì)胞表面的親和力作用,再結(jié)合深度測(cè)序捕獲富集序列�����。與此同時(shí)����,對(duì)CRISPR/Cas的改造,已經(jīng)拓展出遠(yuǎn)遠(yuǎn)超過(guò)其天然核酸酶的功能�,發(fā)展出了轉(zhuǎn)錄調(diào)控、表觀遺傳調(diào)控��、基因組標(biāo)記等豐富多彩的應(yīng)用����。
近日,深圳大學(xué)生命與海洋科學(xué)學(xué)院王宇課題組�����,聯(lián)合廣州實(shí)驗(yàn)室趙金存教授���,清華大學(xué)譚旭研究員�����,中國(guó)科學(xué)院動(dòng)物研究所周兵研究員以及深圳疾控中心張仁利教授�,在Advanced Science(IF=17.5)上發(fā)表了題目為Repurposing CRISPR/Cas to Discover SARS-CoV-2Detecting and Neutralizing Aptamers的文章,報(bào)道了一種新穎的基于CRISPR/Cas的RNA配體篩選系統(tǒng):CRISmers(CRISPR based aptamersscreening system)�����。有別于傳統(tǒng)的SELEX篩選�,CRISmers將RNA適配體篩選從溶液體系或者細(xì)胞表面搬到了細(xì)胞內(nèi)���,從而提供了胞內(nèi)天然生物環(huán)境下的RNA和蛋白質(zhì)的折疊與相互作用����,并避免了篩選過(guò)程中的環(huán)境波動(dòng)影響�����。CRISmers通過(guò)CRISPR/Cas的轉(zhuǎn)錄激活功能����,將RNA適配體與靶蛋白的親和作用轉(zhuǎn)化為抗生素篩選壓力下細(xì)胞的存活能力,以每個(gè)單細(xì)胞作為相互隔離的物理單元���,區(qū)分功能性事件和背景噪音�。

首先,該團(tuán)隊(duì)設(shè)想了CRISmers的概念�����,然后應(yīng)用GFP和此前經(jīng)SELEX篩選獲得的RNA適配體進(jìn)行了初步的概念驗(yàn)證和篩選系統(tǒng)的關(guān)鍵參數(shù)指征��,從而得到了CRISmers篩選系統(tǒng)的工作流程�����。簡(jiǎn)單來(lái)說(shuō)��,將適配體隨機(jī)序列文庫(kù)以pooled方式構(gòu)入進(jìn)sgRNA骨架�����,若文庫(kù)中含有與特定靶蛋白結(jié)合的親和序列��,即可招募與靶蛋白融合的轉(zhuǎn)錄激活因子����,從而激活下游抗性基因的表達(dá)。通過(guò)施加抗性篩選壓力��,即可將攜帶親和配體的細(xì)胞在體系中富集。包含RNA適配體的文庫(kù)通過(guò)慢病毒遞送���,整合進(jìn)入細(xì)胞基因組����。RNA適配體的序列信息可以通過(guò)提取基因組�、定向擴(kuò)增配體區(qū)段、以及深度測(cè)序獲取��。
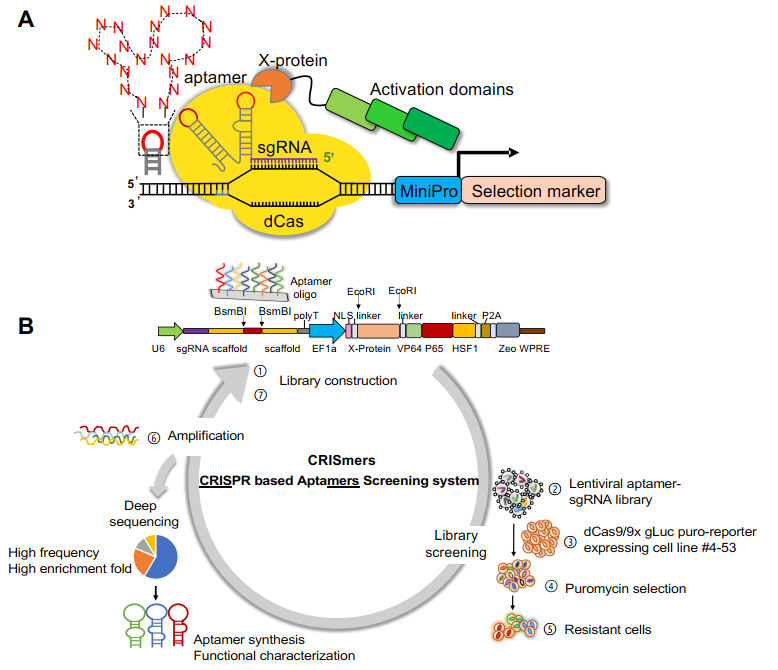
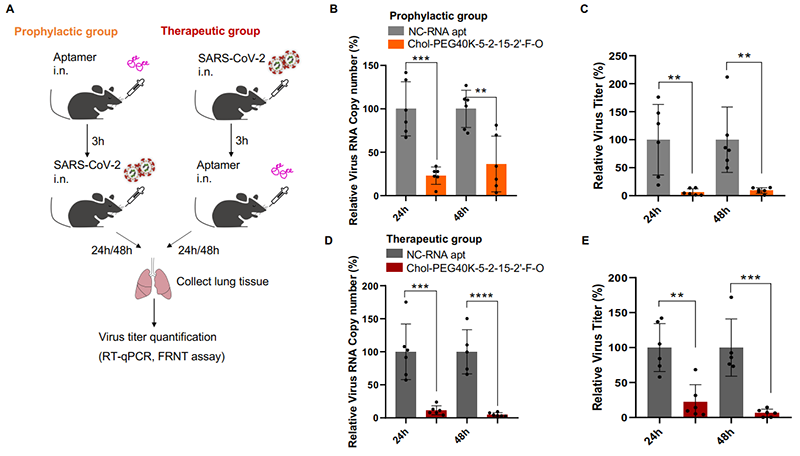
CRISmers理論上具有廣泛的靶向性����,但考慮到研究進(jìn)行期間正值新冠疫情���,該團(tuán)隊(duì)將第一個(gè)靶標(biāo)指向了SARS-CoV-2刺突蛋白受體結(jié)構(gòu)域RBD����。通過(guò)初級(jí)篩選和二級(jí)驗(yàn)證�,獲得了可特異靶向RBD的2個(gè)優(yōu)選的RNA適配體,且在體外呈現(xiàn)出有效的病毒檢測(cè)和中和活性��。有趣的是��,和其他論文中報(bào)道的一致,核酸配體表現(xiàn)出不受病毒突變影響的現(xiàn)象�,具有廣譜抗SARS-CoV-2的潛力。這一現(xiàn)象也許和核酸配體內(nèi)在的柔性結(jié)構(gòu)特性有關(guān)�。類似的,不同的CRISPR/Cas系統(tǒng)的向?qū)NA也觀察到可以互換的現(xiàn)象��。進(jìn)一步�,選取其中一條RNA適配體,團(tuán)隊(duì)發(fā)現(xiàn)�,結(jié)合多種修飾和偶聯(lián),包括2’-氟嘧啶和2’-甲氧基RNA修飾(提升RNA穩(wěn)定性)�,以及5’端膽固醇(呈遞到呼吸道上皮細(xì)胞表面)和分子量為40kDa的聚乙二醇(延長(zhǎng)體內(nèi)半衰期)的偶聯(lián),經(jīng)滴鼻給藥����,在小鼠體內(nèi)實(shí)現(xiàn)了對(duì)Omicron BA.2活病毒的預(yù)防型和治療型抗病毒中和活性。通過(guò)對(duì)比實(shí)驗(yàn)��,團(tuán)隊(duì)發(fā)現(xiàn)膽固醇和聚乙二醇的偶聯(lián)對(duì)于動(dòng)物體內(nèi)的活性不可或缺����,盡管它們對(duì)于細(xì)胞水平上的中和活性可有可無(wú)。
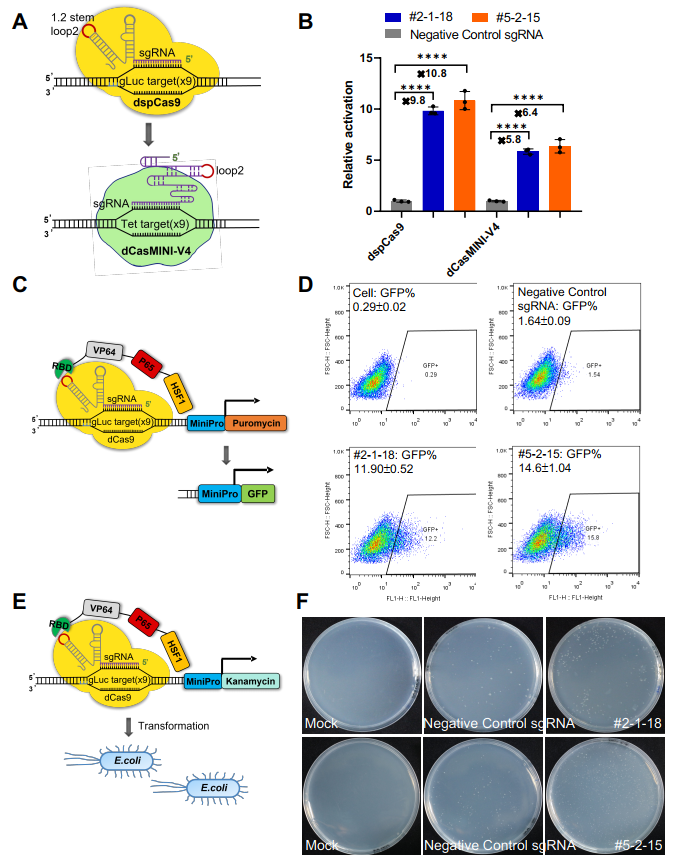
最后����,該團(tuán)隊(duì)還對(duì)CRISmers系統(tǒng)的通用適配性進(jìn)行了驗(yàn)證���。應(yīng)用靶向SARS-CoV-2 RBD篩選獲得的兩個(gè)RNA配體,對(duì)CRISmers系統(tǒng)中的元件分別進(jìn)行了替換���,包括(1)將dSpCas9替換成更小體積版本的dCasMINI-V4(2)將抗性基因替換成熒光蛋白��;(3)將篩選宿主細(xì)胞由人HEK293T細(xì)胞系替換成大腸桿菌��,均可捕獲到RNA配體與RBD的親和力信號(hào)�。
近年來(lái)核酸藥物的成功主要來(lái)自于以“信息分子”發(fā)揮作用的方式�����,包括siRNA, ASO, mRNA��。與之對(duì)應(yīng)的是��,RNA作為“結(jié)構(gòu)分子”雖然對(duì)于生物學(xué)的很多方面也非常重要(某種意義上�����,CRISPR/Cas中的向?qū)NA就是一個(gè)大aptamer?�。?����,但是以這樣的角色轉(zhuǎn)化為藥物�����,雖然潛力巨大�,但尚待發(fā)掘。CRISmers作為研究RNA作為“結(jié)構(gòu)分子”的工具技術(shù)將可能發(fā)揮一定的作用���。另外�����,CRISmers盡管看起來(lái)也適用于膜外的靶標(biāo)����,理論上而言對(duì)于膜內(nèi)的靶標(biāo)具有更加獨(dú)特的價(jià)值�。siRNA和mRNA等核酸藥物跨過(guò)細(xì)胞膜對(duì)于實(shí)現(xiàn)它們的臨床應(yīng)用具有重要意義。隨著核酸遞送技術(shù)的進(jìn)步�,胞內(nèi)靶點(diǎn)對(duì)于核酸藥物而言也許將逐步獲得和小分子化學(xué)藥一樣的可及性。因此�,鑒于該論文的工作僅僅是CRISmers的第一個(gè)靶點(diǎn),且位于病毒表面��,該篩選系統(tǒng)尚待更多靶標(biāo)和更長(zhǎng)時(shí)間的檢驗(yàn)。當(dāng)下���,基于上述成果����,團(tuán)隊(duì)正在推進(jìn)抗新冠病毒的候選鼻噴藥物面向臨床應(yīng)用的開發(fā)工作����。最新的測(cè)試顯示�,論文中報(bào)道的優(yōu)選RNA適配體對(duì)于XBB.1.5和XBB.1.16假病毒保持活性。與此同時(shí)���,面向后疫情時(shí)代,CRISmers正在被用于靶向癌癥等疾病的研究��。
中國(guó)科學(xué)院動(dòng)物研究所博士生張菊和廣州實(shí)驗(yàn)室博士后朱愛如為該論文的共同第一作者���,王宇教授���、趙金存教授����、譚旭研究員����、周兵研究員、張仁利教授為該論文共同通訊作者�。
原文鏈接:https://doi.org/10.1002/advs.202300656
(生命與海洋科學(xué)學(xué)院 供稿)





