近日�����,深圳大學(xué)醫(yī)學(xué)部生物醫(yī)學(xué)工程學(xué)院黃鵬特聘教授團(tuán)隊(duì)張一帆助理教授在Science合作期刊《Research》(影響因子11.0�,中科院一區(qū),TOP期刊)上發(fā)表了題為《Traceable Lactate-Fueled Self-Acting Photodynamic Therapy Against Triple-Negative Breast Cancer》的研究論文�����。該團(tuán)隊(duì)張一帆助理教授和馮光樂碩士生為論文共同第一作者�,黃鵬教授為通訊作者,深圳大學(xué)為唯一單位和唯一通訊單位�,該團(tuán)隊(duì)所在的生物醫(yī)學(xué)工程學(xué)科屬于廣東省優(yōu)勢(shì)重點(diǎn)學(xué)科。

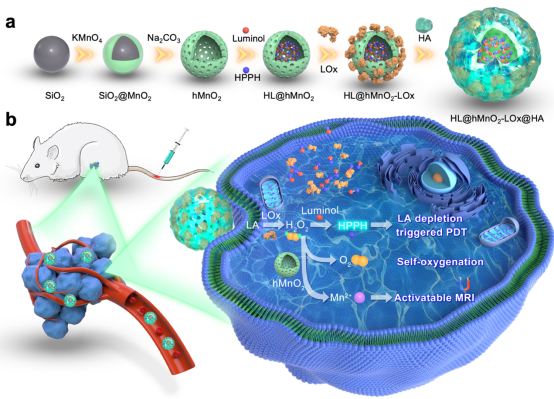
三陰性乳腺癌(TNBC)是乳腺癌中預(yù)后最差的一種亞型����,主要原因是除全身化療外缺乏其他有效的治療方法�,而且具有侵襲性��。光動(dòng)力療法(PDT)通過時(shí)空控制的光照實(shí)現(xiàn)癌癥靶向治療�,產(chǎn)生足夠的單線態(tài)氧消滅腫瘤細(xì)胞。然而�����,TNBC腫瘤的缺氧狀態(tài)嚴(yán)重阻礙了PDT的氧氣供應(yīng)�����。此外��,光在TNBC腫瘤中的穿透深度有限�����。為了解決上述問題����,該團(tuán)隊(duì)通過在中空二氧化錳納米粒子中共同負(fù)載光克洛(HPPH或Photochlor?)�����、發(fā)光酚和LOx,制備了一種可追蹤的以LA為燃料的自運(yùn)行PDT納米體系����。為了增強(qiáng)腫瘤靶向能力并保護(hù)LOx不被水解,制備的納米粒子用透明質(zhì)酸(HA)裝飾(HLMLH)�。剛開始,LOx消耗瘤內(nèi)LA并產(chǎn)生雙氧水�����。隨后�����,生成的雙氧水氧化發(fā)光酚產(chǎn)生氨酞酸根離子�����,并發(fā)出藍(lán)色熒光�,在約440 nm處達(dá)到峰值。然后���,化學(xué)發(fā)光通過發(fā)光酚和HPPH之間的化學(xué)能量共振轉(zhuǎn)移(CRET)激活HPPH�����,從而實(shí)現(xiàn)熒光成像引導(dǎo)的PDT��。同時(shí)�����,中空二氧化錳載體在酸性腫瘤微環(huán)境中被雙氧水降解并產(chǎn)生氧氣�,從而改善TNBC腫瘤的缺氧狀況,成為PDT的來源��。這一過程伴隨著錳離子的生成�����,錳離子不僅可作為活化MRI的T1造影劑���,還能催化雙氧水分解產(chǎn)生羥基自由基并增強(qiáng)化學(xué)發(fā)光����。因此�����,HLMLH納米系統(tǒng)有望對(duì)TNBC進(jìn)行可追蹤的自發(fā)光/自供氧PDT����。
本研究工作得到了國(guó)家重點(diǎn)研發(fā)計(jì)劃、國(guó)家自然科學(xué)基金����、廣東省基礎(chǔ)研究計(jì)劃、深圳市科技計(jì)劃等項(xiàng)目的支持�。
論文鏈接:https://spj.science.org/doi/abs/10.34133/research.0277
(來源 醫(yī)學(xué)部)





