2024年4月,深圳大學(xué)醫(yī)學(xué)部許興智教授團(tuán)隊(duì)與山東大學(xué)汪兆琦教授團(tuán)隊(duì)合作���,共同在國際頂級(jí)期刊PNAS發(fā)表題為“PARP1 UFMylation ensures the stability of stalled replication forks”的研究論文���。這是許興智教授團(tuán)隊(duì)繼2019年首次詮釋UFM1修飾(UFMylation)在DNA損傷應(yīng)答(DDR)中促進(jìn)DDR核心激酶ATM活化的分子機(jī)制后,再次率先揭示了UFM1修飾維持被阻滯復(fù)制叉的穩(wěn)定性���,進(jìn)而維持基因組穩(wěn)定性的作用機(jī)理�����。深圳大學(xué)醫(yī)學(xué)部博士生龔亞民�、助理教授王志峰和山東大學(xué)助理研究員宗文為共同第一作者�,許興智教授和汪兆琦教授為共同通訊作者,深圳大學(xué)為第一單位���。
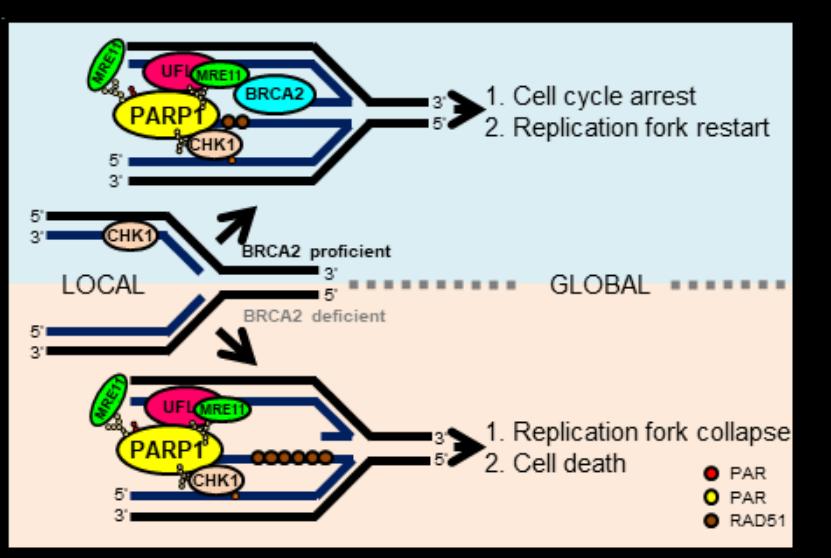
基因組DNA的高保真復(fù)制和合適的DNA復(fù)制脅迫應(yīng)答是維持基因組穩(wěn)定性和細(xì)胞增殖的根本保障�,其異常與大多數(shù)腫瘤的發(fā)生和發(fā)展密切相關(guān)����,因此,其調(diào)控網(wǎng)絡(luò)也是腫瘤治療的核心靶標(biāo)。作為2004年才被發(fā)現(xiàn)的最新型類泛素修飾—UFM1修飾,至今被發(fā)現(xiàn)的修飾底物非常有限��,卻已被證明在胚胎發(fā)育�、內(nèi)質(zhì)網(wǎng)穩(wěn)態(tài)、蛋白質(zhì)量控制��、DDR等生命活動(dòng)中起重要作用�����,然而在DNA復(fù)制脅迫應(yīng)答中的功能尚有待挖掘�。在該研究中,許教授團(tuán)隊(duì)發(fā)現(xiàn)UFM1修飾缺陷導(dǎo)致復(fù)制脅迫子下被阻滯的復(fù)制叉不穩(wěn)定和染色體畸變率顯著升高���,進(jìn)一步發(fā)現(xiàn)多聚(ADP-核糖)聚合酶PARP1的548位賴氨酸(K548)發(fā)生UFM1修飾�����,該修飾促進(jìn)PARP1的酶性活化和在復(fù)制叉上的招募����、細(xì)胞周期檢驗(yàn)點(diǎn)激酶CHK1的激活和核酸酶MRE11到被阻滯復(fù)制叉的招募�����,進(jìn)而促進(jìn)BRCA1/2缺陷細(xì)胞中核酸酶MRE11對(duì)被阻滯復(fù)制叉的降解��,而在BRCA1/2正常細(xì)胞中促進(jìn)被阻滯復(fù)制叉重啟����,維持基因組穩(wěn)定。肺癌病人的腫瘤細(xì)胞突變PARP1(F553L)展現(xiàn)出與UFM1修飾缺陷PARP1(K548R)相似的細(xì)胞表型�。該研究成果揭示了UFM1修飾維持被阻滯復(fù)制叉穩(wěn)定和基因組完整的作用機(jī)理,為基因組不穩(wěn)定相關(guān)疾病的診治提供了新的潛在策略�����。
據(jù)悉�,浙江大學(xué)劉婷教授也在Nat Chem Biol雜志發(fā)文,揭示UFL1催化PTIP的UFM1修飾����,從而維持被阻滯復(fù)制叉的穩(wěn)定性。
該研究依托廣東省基因組穩(wěn)定性與疾病防治重點(diǎn)實(shí)驗(yàn)室平臺(tái)��,并獲得了國家自然科學(xué)基金�、國家重點(diǎn)研發(fā)計(jì)劃、深圳科技創(chuàng)新委員會(huì)項(xiàng)目和“珠江人才計(jì)劃”引進(jìn)高層次人才的資助�。
原文鏈接:https://doi.org/10.1073/pnas.2322520121





