2024年5月�,深圳大學(xué)醫(yī)學(xué)部許興智教授團隊在國際頂級期刊Autophagy發(fā)表題為“VCP/p97 UFMylation stabilizes BECN1 and facilitates the initiation of autophagy”的研究論文。這是許興智教授團隊繼2019年首次詮釋UFMylation在DNA損傷應(yīng)答(DDR)中促進DDR核心激酶ATM活化和上月(2024年4月)揭示UFMylation維持被阻滯復(fù)制叉穩(wěn)定性的分子機制后��,再次率先揭示了UFMylation促進細胞自噬的作用機理�。深圳大學(xué)醫(yī)學(xué)部助理教授王志峰博士為第一作者���,王志峰助理教授和許興智教授為共同通訊作者,深圳大學(xué)為第一單位��。

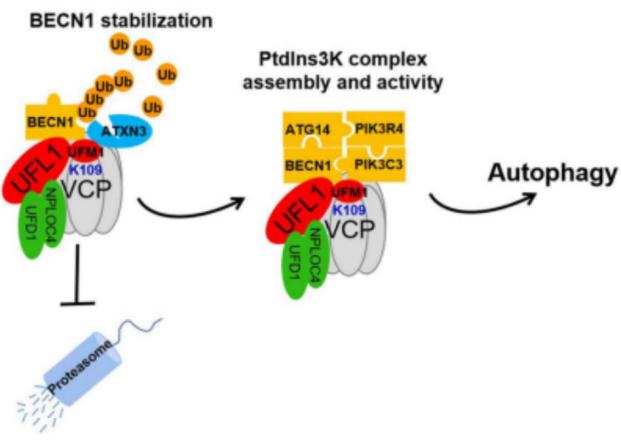
細胞自噬(Autophagy)是真核生物中進化保守的�、對細胞內(nèi)物質(zhì)進行周轉(zhuǎn)的重要過程。該過程中一些受損蛋白或細胞器被膜性小泡(自噬小泡)包裹后����,與溶酶體(或液泡)融合并降解,從而得以循環(huán)利用�。自噬過程與癌癥、帕金森綜合征和II-型糖尿病等老年疾病密切相關(guān)��。猶素(UFM1)作為最晚被發(fā)現(xiàn)的類泛素蛋白,已被證明在胚胎發(fā)育���、內(nèi)質(zhì)網(wǎng)穩(wěn)態(tài)�����、蛋白質(zhì)量控制����、DDR等生命活動中起重要作用,然而在細胞自噬中的功能尚不清楚�。在該研究中,許教授團隊發(fā)現(xiàn)轉(zhuǎn)位酶VCP/p97的109位賴氨酸(K109)發(fā)生UFMylation��,該修飾一方面促進去泛素化酶ATXN3對BECN1的去泛素化作用����,從而抑制BECN1蛋白降解,導(dǎo)致BECN1蛋白大量累積���。作為自噬的重要起始因子�,BECN1可以介導(dǎo)PtdIns3K復(fù)合物的形成����。另一方面����,UFMylation穩(wěn)定VCP/p97作為支架蛋白的作用直接促進PtdIns3K復(fù)合物的形成,最終起始自噬�。該研究成果揭示了UFMylation通過促進VCP/p97-ATXN3-BECN1-PtdIns3K軸起始細胞自噬的作用機理,為腫瘤���、帕金森綜合征和II-型糖尿病等老年疾病的診治提供了新的思路和策略�����。
該研究依托廣東省基因組穩(wěn)定性與疾病防治重點實驗室平臺��,馬歇爾生物醫(yī)學(xué)工程實驗室卡爾森國際腫瘤中心�,并獲得了國家自然科學(xué)基金和國家重點研發(fā)計劃的資助。
原文鏈接:https://doi.org/10.1080/15548627.2024.2356488
同時�����,許教授團隊的另一項研究(PTIP UFMylation promotes replication fork degradation in BRCA1-deficient cells)也于近期發(fā)表在國際知名期刊Journal of Biological Chemistry�,該研究發(fā)現(xiàn)在BRCA1基因缺陷細胞中,染色質(zhì)調(diào)節(jié)因子Pax2反式激活結(jié)構(gòu)域互作蛋白PTIP的UFMylation促進了新生DNA在被阻滯復(fù)制叉上的末端切除和降解��,從而產(chǎn)生化療抗性��。深圳大學(xué)醫(yī)學(xué)部博士后檀群松博士為第一作者�����,許興智教授為通訊作者�����,深圳大學(xué)為第一單位���。
原文鏈接:https://doi.org/10.1016/j.jbc.2024.107312





